برای دانلود سریع فایل کافیست روی دکمهی پایین کلیک کنید برای دانلود اینجا کلیک فرمایید ( مقاله فاز در شیمی )

· • • • • • • • °° • مقاله فاز در شیمی مقاله فاز در شیمی تعریفی دقیق تر فاز به ناحیه ای از فضا گفته می شود که ترکیب شیمیایی یکنواخت یا تقریبا یکنواختی دارد بر اساس این تعریف، باز هم این که ماده از چه جنسی باشد اهمیتی ندارد و صرفا حالت فیزیکی ماده تعیین کننده محدوده فاز ها می باشد اما یک مطلب ساده اضافه شده است گفته شده که ترکیب شیمیایی محدوده فاز با ید یکنواخت یا تقریبا یکنواخت باشد › فاز چیست؟ تعریف های مختلف آن چگونه است؟ شیمی دون فاز ماده ویکیپدیا، دانشنامهٔ آزاد › › فازمادهفاز ماده ویکیپدیا، دانشنامهٔ آزاد › › فازماده هر فاز را می توان بخشی از ماده در نظر گرفت که تمام خواص آن از نظر ترکیب شیمیایی و خواص فیزیکی یکسان باشد فاز بخشی از سامانه است که خواص شدتی آن در تمامی نقاط یکسان است الکتروشیمی دانلود مقالات الکتروشیمی مقاله › › الکتروشیمی دانلود مقالات الکتروشیمی مقاله › › در این صفحه تعداد مقاله تخصصی درباره الکتروشیمی که در نشریه های معتبر علمی و پایگاه ساینس دایرکت منتشر شده، نمایش داده شده است مقاله نشریه بررسی ضریب های انتقال جرم، درصد استخراج و ماندگی › › مقاله نشریه بررسی ضریب های انتقال جرم، درصد استخراج و ماندگی › › کلیدواژه فاز پراکنده ، ضریب انتقال جرم ، استخراج مایعمایع ، ماندگی موضعی ، ستون پاشنده چکیده به طور معمول در فرآيندهاي استخراج مايعمايع يك فاز به صورت فاز پراكنده قطره در فاز پيوسته حركت سینتیک شیمیایی و عوامل موثر بر سرعت واکنش ها جهان شیمی فیزیک › سینتیک شیمیایی و عوامل موثر بر سرعت واکنش ها جهان شیمی فیزیک › فهرست مطالب ۱ تاریخچه ۲ سینتیک واکنش شیمیایی چیست؟ ۳ سرعت واکنش دهنده ها و فرآورده ها ۴ سرعت متوسط – ۵ رابطه سرعت ۶ عوامل موثر بر سرعت واکنش های شیمیایی ۱ تاریخچه ۲ سینتیک واکنش شیمیایی چیست؟ ۳ سرعت واکنش دهنده ها و فرآورده ها ۴ سرعت متوسط – ۵ رابطه سرعت ۶ عوامل موثر بر سرعت واکنش های شیمیایی ۶۱ غلظت ۶۲ دما ۶۳ فاز و سطح واکنش دهنده ها ۶۴ اثر فشار ۶۵ کاتالیزگر اولین کسی که به ممطالعه سرعت واکنش های شیمیاییپرداخت، ونزل در سال ۱۷۷۷ بود که سرعت حل شدن فلزات در اسیدها را بررسی کرد در سال ۱۸۵۰ ویلهی با مطالعه سرعت هیدرولیز اسیدها متوجه شد، سرعت این واکنش به غلظت ساکاروز تجزیه نشده اولیه بستگی دارد در سال ۱۸۶۳ نتایج آزمایشات برتلو و سن زیل مطالعه سرعت هیدرولیز استرها در اسید را تکمیل کرده و قانون اثر غلظ به علم مطالعه سرعت انجام واکنش های شیمیایی و عوامل موثر بر آن مثل دما، غلظت واکنش دهنده ها و فرآورده ها، فشار و … سینتیک شیمیایی می گویند در علم سینتیک حتی اطلاعات زیادی در مورد مکانیسم و مراحل انجام واکنش های شیمیایی و کنترل واکنش و توضیح گونه های انجام دهنده واکنش می توانیم به دست آوریم واکنش ها بر اساس سرعت انجام آن به دسته های زیر تقسیم می شو در یک واکنش شیمیایی به تدریج با پیشرفت واکنش و گذر زمان از مقدار مواد واکنش دهنده ها کاسته شده و بر مقدار فرآورده ها افزوده می شود اگر نمودار غلظت برحسب زمان برای یک واکنش شیمیایی را رسم کنیم، نمودار غلظت واکنش دهنده ها با گذر زمان منفی و نمودار غلظت فرآورده ها مثبت خواهد بود برای تعیین سرعت واکنش باید سرعت مصرف شدن واکنش دهنده ها و سرعت تولید فر به سرعت مصرف و تولید ماده در واکنش شیمیایی را در واحد زمان سرعت متوسط گویند که با –نشان می دهند که از کلمه به معنای سرعت گرفته شده است به تعداد مول های مصرف شده در واحد زمان سرعت متوسط یک واکنش دهنده و به تعداد مول های تولید شده در واحد زمان سرعت متوسط یک فرآورده طبق رابطه زیر می گویند – Δ ̸ Δبرای واکنش دهنده – Δ ̸ Δبرای فرآورد اگر ضرایب استوکیومتری واکنش یکسان نباشد برای بیان کردن رابطه سرعت واکنش، با در نظر گرفتن واکنش کلی زیر داریم → ̸ ₓ ̸ ̸ ₓ ̸ ̸ ₓ ̸ ̸ ₓ ̸ در این معادله بالا و رابطه سرعت حروف کوچک ضرایب استوکیومتری و حروف بزرگ واکنش دهنده ها و محصولات واکنش هستند پ ۶۱ غلظت در یک واکنش شیمیایی برای تشکیل محصول مواد واکنش دهنده با هم برخورد می کنند اگر برخوردی وجود نداشته باشد هیچ واکنشی اتفاق نمی افتد و سرعت واکنش صفر می شود هرچه غلظت مواد اولیه بیشتر باشد، تعداد برخورد بین آن ها و در نتیجه آن تعداد برخوردهای موثر بیشتر شده و سرعت واکنش افزایش می یابد ۶۲ دما هر چه دمای یک واکنش افزایش یابد انرژی جنبشی ذرات واکنش دهنده افزایش یافته و ذرات با شدت بیشتری به هم برخورد می کنند و سرعت حرکت آن ها نیز زیاد می شود در نتیجه تعداد برخوردها و به دنبال آن تعداد برخوردهای موثر زیاد شده و سرعت واکنش افزایش می یابد برعکس کاهش دما باعث کاهش انرژی ذرات و کاهش سرعت واکنش می شود به عنوان مثال با گذاشتن مواد غذایی در فریزر و انجماد آن ها سرعت رشد باکتری ها کاهش یافته و مواد دیرتر فاسد می شوند نکته گرماگیر یا گرمادهبودن واکنش ها باعث می شود افزایش دما روی واکنش ۶۳ فاز و سطح واکنش دهنده ها در انجام یک واکنش شیمیایی اگر مواد واکنش دهنده با هم دریک فاز باشند، مثلا به شکل مایع باشند و در هم حل شوند، واکنش با سرعت بیشتری انجام می شود همچنین واکنش دهنده ها به شکل مایع چون آزادی حرکت بیشتری دارند، در مقایسه با فاز جامد، ذرات آن تعداد برخورد بیشتری داشته و سرعت انجام واکنش افزایش می یابد اگر مواد اولیه جامد باشد با خرد کردن مواد جامد به قطعات ریز، سطح تماس بین ذرات بیشتر شده، سرعت واکنش افزایش می یابد روشی دیگر برای افزایش سرعت واکنش دو جامد، افزودن حلال به آن هاست تعادل فازی در ترمودینامیک از صفر تا صد فرادرس مجله تعادل فازی در ترمودینامیک از صفر تا صد فرادرس مجله › تعادلفازیدرتعادل فازی در ترمودینامیک از صفر تا صد – فرادرس مجله › تعادلفازیدر تعادل فازی برای سیستمهای چندجزئی بسیاری از سیستمهای چند فازی در عمل دارای دو یا بیش از دو جزء هستند یک سیستم چند فازی چند جزئی در دما و فشار مشخص، هنگامی در تعادل فازی قرار دارد که در آن نشریه ایرانی شیمی تجزیه نشریه ایرانی شیمی تجزیه در این کار تحقیقی، یک روش جدید، ساده و سریع استخراج فاز جامداندازه گیری طیف نورسنجی فسفات با استفاده از ستیل تری متیل آمونیوم برمید نشانده بر روی نانوذرات مغناطیسی پوشیده با آلومینا
برای دانلود فایل بر روی دکمه زیر کلیک کنید
دانلود مستقیم و سریع
برای دانلود اینجا کلیک فرمایید ( مقاله فاز در شیمی )
برای دانلود سریع فایل کافیست روی دکمهی پایین کلیک کنید برای دانلود اینجا کلیک فرمایید ( مقاله فاز در شیمی )

· • • • • • • • °° • مقاله فاز در شیمی مقاله فاز در شیمی تعریفی دقیق تر فاز به ناحیه ای از فضا گفته می شود که ترکیب شیمیایی یکنواخت یا تقریبا یکنواختی دارد بر اساس این تعریف، باز هم این که ماده از چه جنسی باشد اهمیتی ندارد و صرفا حالت فیزیکی ماده تعیین کننده محدوده فاز ها می باشد اما یک مطلب ساده اضافه شده است گفته شده که ترکیب شیمیایی محدوده فاز با ید یکنواخت یا تقریبا یکنواخت باشد › فاز چیست؟ تعریف های مختلف آن چگونه است؟ شیمی دون فاز ماده ویکیپدیا، دانشنامهٔ آزاد › › فازمادهفاز ماده ویکیپدیا، دانشنامهٔ آزاد › › فازماده هر فاز را می توان بخشی از ماده در نظر گرفت که تمام خواص آن از نظر ترکیب شیمیایی و خواص فیزیکی یکسان باشد فاز بخشی از سامانه است که خواص شدتی آن در تمامی نقاط یکسان است الکتروشیمی دانلود مقالات الکتروشیمی مقاله › › الکتروشیمی دانلود مقالات الکتروشیمی مقاله › › در این صفحه تعداد مقاله تخصصی درباره الکتروشیمی که در نشریه های معتبر علمی و پایگاه ساینس دایرکت منتشر شده، نمایش داده شده است مقاله نشریه بررسی ضریب های انتقال جرم، درصد استخراج و ماندگی › › مقاله نشریه بررسی ضریب های انتقال جرم، درصد استخراج و ماندگی › › کلیدواژه فاز پراکنده ، ضریب انتقال جرم ، استخراج مایعمایع ، ماندگی موضعی ، ستون پاشنده چکیده به طور معمول در فرآيندهاي استخراج مايعمايع يك فاز به صورت فاز پراكنده قطره در فاز پيوسته حركت سینتیک شیمیایی و عوامل موثر بر سرعت واکنش ها جهان شیمی فیزیک › سینتیک شیمیایی و عوامل موثر بر سرعت واکنش ها جهان شیمی فیزیک › فهرست مطالب ۱ تاریخچه ۲ سینتیک واکنش شیمیایی چیست؟ ۳ سرعت واکنش دهنده ها و فرآورده ها ۴ سرعت متوسط – ۵ رابطه سرعت ۶ عوامل موثر بر سرعت واکنش های شیمیایی ۱ تاریخچه ۲ سینتیک واکنش شیمیایی چیست؟ ۳ سرعت واکنش دهنده ها و فرآورده ها ۴ سرعت متوسط – ۵ رابطه سرعت ۶ عوامل موثر بر سرعت واکنش های شیمیایی ۶۱ غلظت ۶۲ دما ۶۳ فاز و سطح واکنش دهنده ها ۶۴ اثر فشار ۶۵ کاتالیزگر اولین کسی که به ممطالعه سرعت واکنش های شیمیاییپرداخت، ونزل در سال ۱۷۷۷ بود که سرعت حل شدن فلزات در اسیدها را بررسی کرد در سال ۱۸۵۰ ویلهی با مطالعه سرعت هیدرولیز اسیدها متوجه شد، سرعت این واکنش به غلظت ساکاروز تجزیه نشده اولیه بستگی دارد در سال ۱۸۶۳ نتایج آزمایشات برتلو و سن زیل مطالعه سرعت هیدرولیز استرها در اسید را تکمیل کرده و قانون اثر غلظ به علم مطالعه سرعت انجام واکنش های شیمیایی و عوامل موثر بر آن مثل دما، غلظت واکنش دهنده ها و فرآورده ها، فشار و … سینتیک شیمیایی می گویند در علم سینتیک حتی اطلاعات زیادی در مورد مکانیسم و مراحل انجام واکنش های شیمیایی و کنترل واکنش و توضیح گونه های انجام دهنده واکنش می توانیم به دست آوریم واکنش ها بر اساس سرعت انجام آن به دسته های زیر تقسیم می شو در یک واکنش شیمیایی به تدریج با پیشرفت واکنش و گذر زمان از مقدار مواد واکنش دهنده ها کاسته شده و بر مقدار فرآورده ها افزوده می شود اگر نمودار غلظت برحسب زمان برای یک واکنش شیمیایی را رسم کنیم، نمودار غلظت واکنش دهنده ها با گذر زمان منفی و نمودار غلظت فرآورده ها مثبت خواهد بود برای تعیین سرعت واکنش باید سرعت مصرف شدن واکنش دهنده ها و سرعت تولید فر به سرعت مصرف و تولید ماده در واکنش شیمیایی را در واحد زمان سرعت متوسط گویند که با –نشان می دهند که از کلمه به معنای سرعت گرفته شده است به تعداد مول های مصرف شده در واحد زمان سرعت متوسط یک واکنش دهنده و به تعداد مول های تولید شده در واحد زمان سرعت متوسط یک فرآورده طبق رابطه زیر می گویند – Δ ̸ Δبرای واکنش دهنده – Δ ̸ Δبرای فرآورد اگر ضرایب استوکیومتری واکنش یکسان نباشد برای بیان کردن رابطه سرعت واکنش، با در نظر گرفتن واکنش کلی زیر داریم → ̸ ₓ ̸ ̸ ₓ ̸ ̸ ₓ ̸ ̸ ₓ ̸ در این معادله بالا و رابطه سرعت حروف کوچک ضرایب استوکیومتری و حروف بزرگ واکنش دهنده ها و محصولات واکنش هستند پ ۶۱ غلظت در یک واکنش شیمیایی برای تشکیل محصول مواد واکنش دهنده با هم برخورد می کنند اگر برخوردی وجود نداشته باشد هیچ واکنشی اتفاق نمی افتد و سرعت واکنش صفر می شود هرچه غلظت مواد اولیه بیشتر باشد، تعداد برخورد بین آن ها و در نتیجه آن تعداد برخوردهای موثر بیشتر شده و سرعت واکنش افزایش می یابد ۶۲ دما هر چه دمای یک واکنش افزایش یابد انرژی جنبشی ذرات واکنش دهنده افزایش یافته و ذرات با شدت بیشتری به هم برخورد می کنند و سرعت حرکت آن ها نیز زیاد می شود در نتیجه تعداد برخوردها و به دنبال آن تعداد برخوردهای موثر زیاد شده و سرعت واکنش افزایش می یابد برعکس کاهش دما باعث کاهش انرژی ذرات و کاهش سرعت واکنش می شود به عنوان مثال با گذاشتن مواد غذایی در فریزر و انجماد آن ها سرعت رشد باکتری ها کاهش یافته و مواد دیرتر فاسد می شوند نکته گرماگیر یا گرمادهبودن واکنش ها باعث می شود افزایش دما روی واکنش ۶۳ فاز و سطح واکنش دهنده ها در انجام یک واکنش شیمیایی اگر مواد واکنش دهنده با هم دریک فاز باشند، مثلا به شکل مایع باشند و در هم حل شوند، واکنش با سرعت بیشتری انجام می شود همچنین واکنش دهنده ها به شکل مایع چون آزادی حرکت بیشتری دارند، در مقایسه با فاز جامد، ذرات آن تعداد برخورد بیشتری داشته و سرعت انجام واکنش افزایش می یابد اگر مواد اولیه جامد باشد با خرد کردن مواد جامد به قطعات ریز، سطح تماس بین ذرات بیشتر شده، سرعت واکنش افزایش می یابد روشی دیگر برای افزایش سرعت واکنش دو جامد، افزودن حلال به آن هاست تعادل فازی در ترمودینامیک از صفر تا صد فرادرس مجله تعادل فازی در ترمودینامیک از صفر تا صد فرادرس مجله › تعادلفازیدرتعادل فازی در ترمودینامیک از صفر تا صد – فرادرس مجله › تعادلفازیدر تعادل فازی برای سیستمهای چندجزئی بسیاری از سیستمهای چند فازی در عمل دارای دو یا بیش از دو جزء هستند یک سیستم چند فازی چند جزئی در دما و فشار مشخص، هنگامی در تعادل فازی قرار دارد که در آن نشریه ایرانی شیمی تجزیه نشریه ایرانی شیمی تجزیه در این کار تحقیقی، یک روش جدید، ساده و سریع استخراج فاز جامداندازه گیری طیف نورسنجی فسفات با استفاده از ستیل تری متیل آمونیوم برمید نشانده بر روی نانوذرات مغناطیسی پوشیده با آلومینا
برای دانلود فایل بر روی دکمه زیر کلیک کنید
دانلود مستقیم و سریع

 بانک فرمول فیزیک
بانک فرمول فیزیک فهرست شهر و شهرستانهای ایرانی
فهرست شهر و شهرستانهای ایرانی روش صرف فعل
روش صرف فعل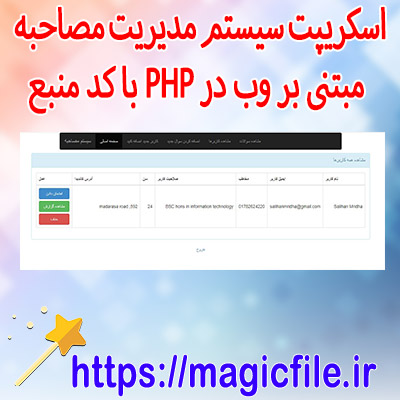 سیستم مدیریت مصاحبه php
سیستم مدیریت مصاحبه php کد چت آنلاین برای سایت
کد چت آنلاین برای سایت بهترین دانلودر اینستاگرام
بهترین دانلودر اینستاگرام سورس و کد نحوه کار با دیتابیس اکسس (MS Access) در ویژوال بیسیک دات نت (VB.Net)
سورس و کد نحوه کار با دیتابیس اکسس (MS Access) در ویژوال بیسیک دات نت (VB.Net) دانلود سورس کد و نرم افزار ارسال پست به انجمن هاي phpBB
دانلود سورس کد و نرم افزار ارسال پست به انجمن هاي phpBB بیسیک فور اندروید سورس
بیسیک فور اندروید سورس سورس و کد نرم افزار پاکسازی فایل های اضافی ویندوز
سورس و کد نرم افزار پاکسازی فایل های اضافی ویندوز دانلود سیستم مدیریت مرخصی آنلاین در کد منبع PHP
دانلود سیستم مدیریت مرخصی آنلاین در کد منبع PHP دانلود نمونه قالب آماده اکسل با موضوع الگوی مسابقه تصویری
دانلود نمونه قالب آماده اکسل با موضوع الگوی مسابقه تصویری بررسی سئو برای ویندوز
بررسی سئو برای ویندوز دانلود نرم افزار ارسال درخواست HTTP پرس و جوهاي POST و GET
دانلود نرم افزار ارسال درخواست HTTP پرس و جوهاي POST و GET تست هوش چندگانه گاردنر اکسل
تست هوش چندگانه گاردنر اکسل مترادف کلمات فارسی به فارسی
مترادف کلمات فارسی به فارسی دانلود اسکریپت پروژه سیستم مدیریت حمل و نقل در PHP با کد منبع
دانلود اسکریپت پروژه سیستم مدیریت حمل و نقل در PHP با کد منبع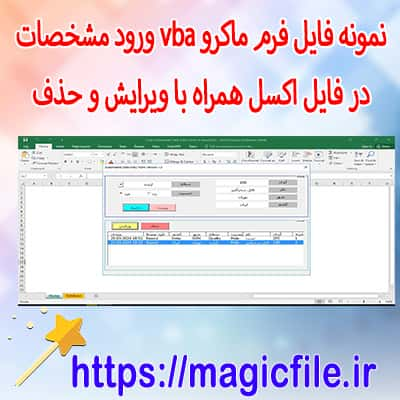 ساخت فرم ورود اطلاعات در vba
ساخت فرم ورود اطلاعات در vba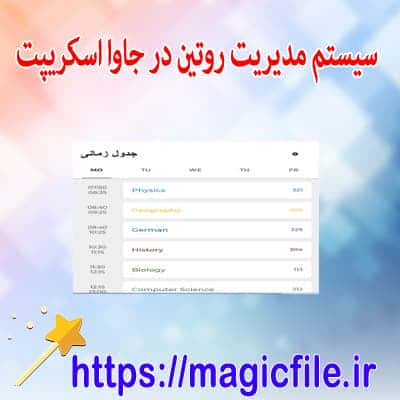 مديريت روتين در جاوا اسکريپت
مديريت روتين در جاوا اسکريپت  نمونه قالب تم پاورپوینت در موضوع سلامتی استراحت و زیبای
نمونه قالب تم پاورپوینت در موضوع سلامتی استراحت و زیبای مجموعه کامل از المان و شابلون معماري ( مبلمان - اشيا - درخت - انسان - ماشين - اندازه صفحات - علايم )
مجموعه کامل از المان و شابلون معماري ( مبلمان - اشيا - درخت - انسان - ماشين - اندازه صفحات - علايم )